Spektroskopi merupakan salah satu cabang ilmu fisika yang mempelajari tentang spektrum yang dihasilkan oleh sebuah materi. Ilmu ini telah berkembang sejak abad ke-17. Cahaya putih (polychromatic) yang terpencar (dispersed) menjadi spektrum warna (monochromatic) ketika dilewatkan sebuah prisma menjadi dasar dari cikal bakal lahirnya ilmu spektroskopi. Sebelum kita belajar spektroskopi atom, kita akan sedikit mengulas pengetahuan tentang atom.
Semua Benda di Alam Semesta Tersusun Atas Atom
Artikel ini di tulis oleh Ali Khumaeni, saat menjadi mahasiswa S3 dengan spesialisasi spektroskopi laser di Fukui University, Jepang yang dimuat di majalah guru1000 dengan judul “Meneropong atom dalam material dengan menggunakan spektroskopi laser”.
Atom merupakan penyusun terkecil dari materi. Batu besar yang ditumbuk akan menghasilkan kerikil-kerikil. Kerikil yang ditumbuk akan menjadi partikel-partikel yang kecil. Jika ditumbuk lagi akan menjadi partikel-partikel yang lebih lembut. Jika terus ditumbuk akan menjadi partikel-partikel yang sangat kecil dan akhirnya menjadi partikel yang lebih kecil lagi dan tidak bisa dipecah lagi yang disebut dengan atom.
Atom terdiri atas proton dan neutron yang ada di inti atom dan elektron yang mengelilingi inti atom. Ilmuwan Denmark, Niels Bohr, menawarkan dua aturan baru tentang elektron di dalam atom, yaitu:
- Elektron bisa mengorbit hanya pada jarak tertentu dari inti atom,
- Atom memancarkan energi jika turun dari orbit energi yang lebih tinggi ke orbit energi yang lebih rendah.
Atom mempunyai tingkatan-tingkatan energi yang berbeda antara atom satu dengan yang lain. Misalnya, atom hidrogen (H) mempunyai tingkatan energi yang berbeda dengan karbon (C). Ilustrasi dari tingkat energi atom H ditunjukkan di gambar 1. n = 1 biasa disebut dengan level energi dasar (ground state) dan n = 2, n = 3, dst, disebut dengan level energi eksitasi (excited state).
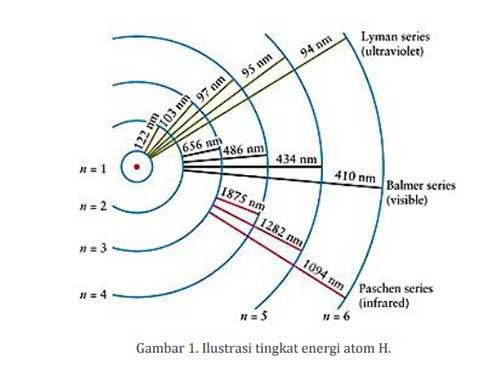
Elektron akan berkumpul di ground state jika tidak ada gangguan dari luar. Jika atom H diberikan energi tertentu dari luar, maka elektron dari n = 2 akan naik (tereksitasi) ke level n = 3 dan akan turun kembali ke level n = 2 dengan memancarkan energi yang mempunyai panjang gelombang 656 nm.
Apabila energi dari luar tersebut cukup besar, maka ada kemungkinan akan naik ke tingkat energi yang lebih tinggi misalnya ke n = 2, n = 3, dst, dan kemudian akan kembali lagi ke level energi n = 2 dengan memancarkan energi yang mempunyai panjang gelombang seperti ditunjukkan pada gambar 1.
Spektroskopi Emisi Atom
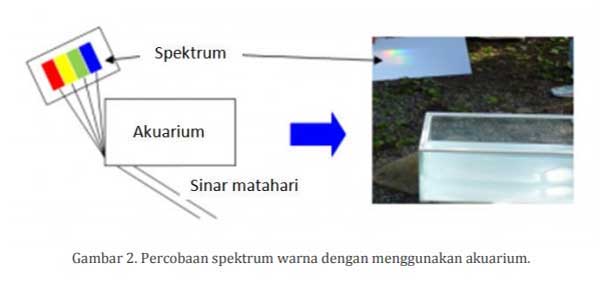
Sebelumnya telah disebutkan di atas bahwa cahaya putih (polychromatic) yang terpencar (dispersed) menjadi spektrum warna (monochromatic) ketika dilewatkan sebuah prisma. Untuk menguji kebenaran bahwa cahaya putih benar-benar terpencar, silahkan melakukan percobaan dengan menggunakan prisma. Kalau tidak mempunyai prisma bagaimana? Karena harga prisma quartz saat ini cukup mahal.
Jangan khawatir karena bisa juga menggunakan akuarium plastik yang bening dan berbentuk kotak. Akuarium tersebut diisi air sampai 1/2 bagian atau penuh. Salah satu sudut akuarium bisa berfungsi sebagai prisma. Coba lihat gambar 2 di bawah ini.
Sekarang kita akan mempelajari spektroskopi emisi atom. Spektroskopi emisi atom merupakan spektroskopi yang didasarkan pada cahaya yang dipancarkan ketika elektron turun dari level energi tinggi ke energi yang lebih rendah.
Sebagaimana telah dijelaskan di atas bahwa jika ada energi dari luar yang mengganggu atom, misalnya energi termal dari flame (api), arc (pengelasan) atau spark (percikan api) yang dihasilkan tegangan tinggi, dan laser pulsa berdaya tinggi, maka elektron dalam atom akan naik dari ground state ke level energi eksitasi dikarenakan penyerapan (absorption) dari energi yang mengganggu.
Elektron kemudian turun kembali ke level ground state dengan memancarkan cahaya (ilmuwan menyebutnya dengan foton). Nah, cahaya yang dipancarkan oleh atom tersebut mempunyai karakteristik khusus sesuai dengan atomnya. Misalnya, atom hidrogen (H) akan menghasilkan panjang gelombang 656, 486, 434 nm dll sebagaimana diperlihatkan pada gambar 1.
Spektroskopi emisi atom dengan menggunakan laser daya tinggi Sekarang kita sudah memahami prinsip kerja dari spektroskopi emisi atom. Sebagaimana dijelaskan diatas, elektron bisa naik ke level energi yang lebih tinggi dan kemudian menghasilkan foton jika kita memberi energi dari luar.
Salah satu energi yang bisa digunakan untuk mengeksitasi atom adalah dengan menembakkan laser pulsa berdaya tinggi (energi sekitar 20 milijoule) ke permukaan material sebagaimana diperlihatkan pada gambar 3.
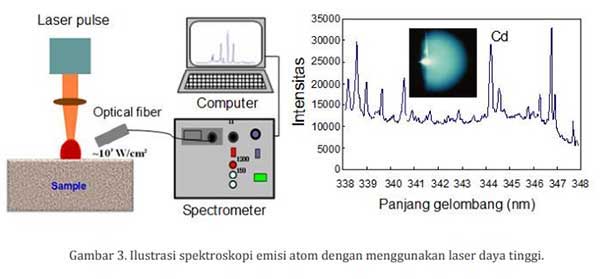
Jika sebuah laser pulsa (laser CO2) ditembakkan ke permukaan sebuah material, maka permukaan material akan terablasi dan atom serta molekul keluar dengan menghasilkan sebuah cahaya plasma sebagaimana diperlihatkan pada gambar 3. Cahaya plasma tersebut mempunyai temperatur yang sangat tinggi sekitar 10,000 K.
Karena temperatur yang tinggi, atom yang ada di dalam plasma tersebut tereksitasi. Dengan menggunakan serat optik (digunakan untuk mengirimkan cahaya ke spektrometer) dan spektrometer (digunakan untuk memancarkan –dispersion- cahaya seperti cara kerja prisma) akan diperoleh spektrum hubungan panjang gelombang dan intensitas sebagaimana pada gambar 3. Panjang gelombang ini merupakan atom-atom yang teridentifikasi dari material yang ditembak.
Dengan menggunakan teknik ini kita bisa mengetahui atom yang terkandung dalam material dalam waktu yang sangat cepat kurang dari 1 menit. Dengan karakteristik khusus yang dimiliki oleh atom, yaitu setiap atom mempunyai panjang gelombang yang berbeda satu sama lain, kita akan bisa mengetahui kandungan semua atom dalam semua material baik itu gas, padat, serbuk, dan cair.
Spektroskopi Emisi Atom






